Антитіла, також звані імуноглобулінами (Ig), є глікопротеїнами, які специфічно зв'язуються з антигенами.
Звичайний препарат антитіл отримують шляхом імунізації тварин і збору антисироватки.Тому антисироватка зазвичай містить антитіла проти інших неспоріднених антигенів та інших білкових компонентів сироватки.Загальні молекули антигену здебільшого містять кілька різних епітопів, тому звичайні антитіла також є сумішшю антитіл проти багатьох різних епітопів.Навіть звичайні сироваткові антитіла, спрямовані проти одного і того ж епітопу, все ще складаються з гетерогенних антитіл, вироблених різними клонами В-клітин.Тому звичайні сироваткові антитіла також називаються поліклональними антитілами або скорочено поліклональними антитілами.
Моноклональне антитіло (моноклональне антитіло) — це однорідне антитіло, що виробляється одним клоном В-клітин і спрямоване лише проти певного епітопу.Його зазвичай готують за технологією гібридоми — технологія гібридомних антитіл базується на технології злиття клітин, поєднуючи В-клітини, здатні виділяти специфічні антитіла, і клітини мієломи з нескінченною здатністю до росту в гібридоми В-клітин.Ця гібридомна клітина має характеристики батьківської клітини.Він може нескінченно та безсмертно розмножуватися in vitro, як клітини мієломи, і може синтезувати та секретувати специфічні антитіла, як лімфоцити селезінки.За допомогою клонування можна отримати моноклональну лінію, отриману з однієї гібридомної клітини, тобто гібридомну клітинну лінію.Антитіла, які він виробляє, є високогомогенними антитілами проти тієї самої антигенної детермінанти, тобто моноклональними антитілами.
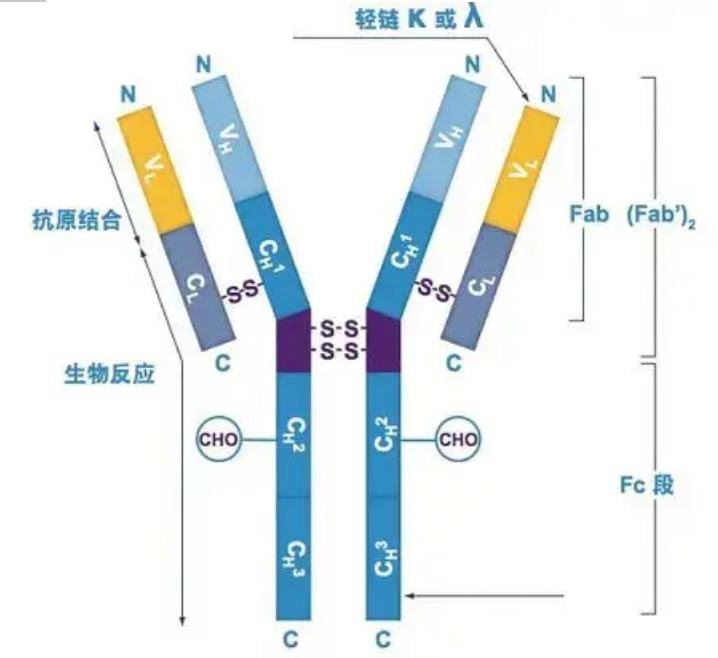
Антитіла існують у вигляді одного або кількох Y-подібних мономерів (тобто моноклональних антитіл або поліклональних антитіл).Кожен Y-подібний мономер складається з 4 поліпептидних ланцюгів, у тому числі двох ідентичних важких ланцюгів і двох ідентичних легких ланцюгів.Легкий ланцюг і важкий ланцюг називаються відповідно до їх молекулярної маси.Вершиною Y-подібної структури є варіабельна область, яка є місцем зв’язування антигену.(Витяг із Концепції біо-моноклональних антитіл Detai)
Будова антитіл
 Важкий ланцюг
Важкий ланцюг
Існує п’ять типів важких ланцюгів Ig ссавців, названих грецькими літерами α, δ, ε, γ та μ.Відповідні антитіла називаються IgA, IgD, IgE, IgG і IgM.Різні важкі ланцюги відрізняються розміром і складом.α і γ містять приблизно 450 амінокислот, тоді як μ і ε містять приблизно 550 амінокислот.
Кожен важкий ланцюг має дві ділянки: постійну область і варіабельну область.Усі антитіла одного типу мають однакову константну ділянку, але між антитілами різних типів є відмінності.Константні ділянки важких ланцюгів γ, α і δ складаються з трьох доменів Ig у тандемі з шарнірною областю для збільшення її гнучкості;константні ділянки важких ланцюгів μ і ε складаються з 4 доменів Ig.Варіабельна область важкого ланцюга антитіла, що виробляється різними В-клітинами, є різною, але варіабельна область антитіла, що виробляється тією самою В-клітиною або клоном клітини, однакова, а варіабельна область кожного важкого ланцюга має довжину приблизно 110 амінокислот., І утворюють один домен Ig.
Легкий ланцюг
У ссавців існує лише два типи легких ланцюгів: тип лямбда і тип каппа.Кожен легкий ланцюг має два пов’язані домени: постійну область і варіабельну область.Довжина легкого ланцюга становить приблизно 211-217 амінокислот.Два легкі ланцюги, що містяться в кожному антитілі, завжди однакові.Для ссавців легкий ланцюг у кожному антитілі має лише один тип: каппа або лямбда.У деяких нижчих хребетних, таких як хрящові риби (хрящові риби) і кісткові риби, також зустрічаються інші типи легких ланцюгів, наприклад йота (йота).
Сегменти Fab і Fc
Сегмент Fc можна безпосередньо поєднувати з ферментами або флуоресцентними барвниками для мічення антитіл.Це частина, де антитіло прикріплюється до пластини під час процесу ELISA, і це також частина, де друге антитіло розпізнається та зв’язується під час імунопреципітації, імуноблоттингу та імуногістохімії.Антитіла можуть бути гідролізовані на два сегменти F(ab) і один сегмент Fc за допомогою протеолітичних ферментів, таких як папаїн, або вони можуть бути відщеплені від шарнірної області пепсином і гідролізовані на один сегмент F(ab)2 і один сегмент Fc.Фрагменти антитіл IgG іноді дуже корисні.Через відсутність сегмента Fc сегмент F(ab) не буде преципітувати з антигеном, а також не буде захоплений імунними клітинами в дослідженнях in vivo.Через малі молекулярні фрагменти та відсутність функції перехресного зшивання (через відсутність сегмента Fc) сегмент Fab зазвичай використовують для радіомічення у функціональних дослідженнях, а сегмент Fc в основному використовують як блокуючий агент при гістохімічному фарбуванні.
Варіабельні та постійні області
Варіабельна область (V-область) розташована на 1/5 або 1/4 (містить приблизно 118 амінокислотних залишків) Н-ланцюга поблизу N-кінця та на 1/2 (містить приблизно 108-111 амінокислотних залишків) поблизу N-кінця L-ланцюга.Кожна область V має пептидне кільце, утворене внутрішньоланцюговими дисульфідними зв’язками, і кожне пептидне кільце містить приблизно від 67 до 75 амінокислотних залишків.Склад і розташування амінокислот у V-області визначають специфічність антигензв'язування антитіла.Через постійну зміну типів і послідовності амінокислот у V-області може утворюватися багато видів антитіл з різною специфічністю зв’язування антигенів.Області V L-ланцюга та Н-ланцюга називаються VL та VH відповідно.У VL і VH амінокислотний склад і послідовність деяких локальних областей мають вищий ступінь варіації.Ці області називають гіперваріабельними областями (HVR).Амінокислотний склад і розташування частин, що не належать до HVR, у V-області є відносно консервативними, що називається каркасною областю.У VL є три гіперваріабельні ділянки, які зазвичай розташовані в амінокислотних залишках 24-34 і 89-97 відповідно.Три HVR VL і VH називаються HVR1, HVR2 і HVR3 відповідно.Дослідження та аналіз рентгенівської кристалічної дифракції довели, що гіперваріабельна область дійсно є місцем, де зв’язується антиген антитіла, тому її називають областю, що визначає комплементарність (CDR).HVR1, HVR2 і HVR3 VL і VH можна назвати CDR1, CDR2 і CDR3 відповідно.Як правило, CDR3 має вищий ступінь гіперваріабельності.Гіперваріабельна область також є основним місцем, де існують ідіотипові детермінанти молекул Ig.У більшості випадків Н-ланцюг відіграє більш важливу роль у зв'язуванні з антигеном.
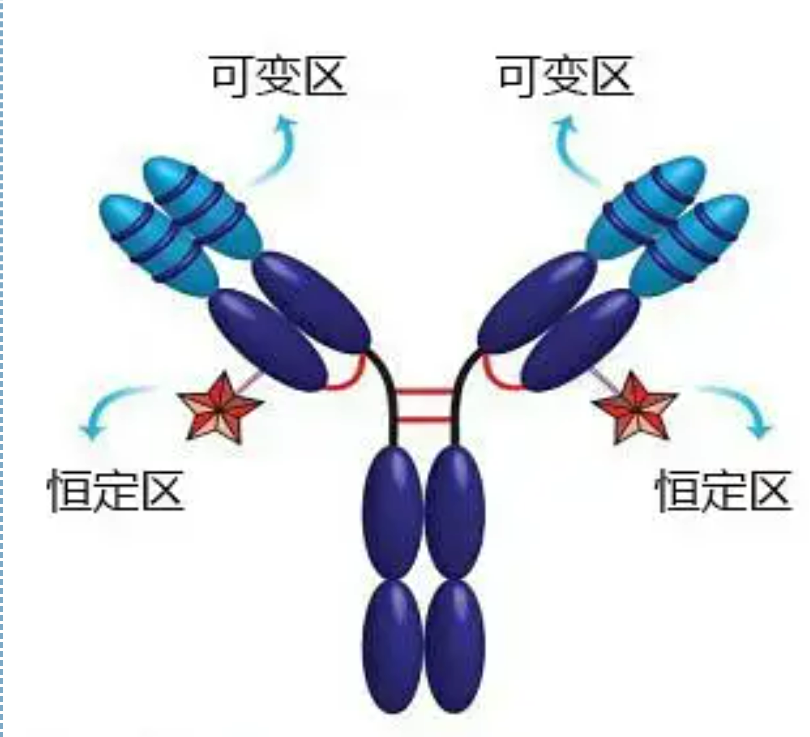 Постійна область (область С)розташований на 3/4 або 4/5 (приблизно від амінокислоти 119 до С-кінца) Н-ланцюга поблизу С-кінця та на 1/2 (містить приблизно 105 амінокислотних залишків) поблизу С-кінця L-ланцюга.Кожна функціональна область ланцюга Н містить близько 110 амінокислотних залишків і містить пептидне кільце, що складається з 50-60 амінокислотних залишків, з’єднаних дисульфідними зв’язками.Амінокислотний склад і розташування цієї ділянки відносно постійні в одному і тому ж ланцюзі L ізотипу Ig тварин і в ланцюзі H того самого типу.Те саме, він може лише специфічно зв’язуватися з відповідним антигеном, але структура його С-області однакова, тобто має однакову антигенність.Вторинне антитіло коня проти людського IgG (або антитіло) можна комбінувати з двома. Виникає комбінація антитіл (IgG) проти різних екзотоксинів.Це важлива основа для приготування вторинних антитіл і застосування флуоресцеїну, ізотопів, ферментів та інших мічених антитіл.
Постійна область (область С)розташований на 3/4 або 4/5 (приблизно від амінокислоти 119 до С-кінца) Н-ланцюга поблизу С-кінця та на 1/2 (містить приблизно 105 амінокислотних залишків) поблизу С-кінця L-ланцюга.Кожна функціональна область ланцюга Н містить близько 110 амінокислотних залишків і містить пептидне кільце, що складається з 50-60 амінокислотних залишків, з’єднаних дисульфідними зв’язками.Амінокислотний склад і розташування цієї ділянки відносно постійні в одному і тому ж ланцюзі L ізотипу Ig тварин і в ланцюзі H того самого типу.Те саме, він може лише специфічно зв’язуватися з відповідним антигеном, але структура його С-області однакова, тобто має однакову антигенність.Вторинне антитіло коня проти людського IgG (або антитіло) можна комбінувати з двома. Виникає комбінація антитіл (IgG) проти різних екзотоксинів.Це важлива основа для приготування вторинних антитіл і застосування флуоресцеїну, ізотопів, ферментів та інших мічених антитіл.
Супутні товари:
Набір Cell Direct RT-qPCR
Час публікації: 30 вересня 2021 р








