Ⅰ. Підвищують чутливість реакційної системи:
1. Відокремити високоякісну РНК:
Успішний синтез кДНК відбувається з високоякісної РНК.Високоякісна РНК повинна забезпечувати принаймні загальне довше і не містити інгібіторів, які не містять записуючих ферментів, таких як EDTA або SDS.Якість РНК визначає максимальне значення інформації про послідовність, яку ви можете транскрибувати в кДНК.Загальний метод очищення РНК є поетапним методом із використанням ізооціанату/ацидофенолу.Щоб запобігти забрудненню РНКазою, РНК, відокремлена від зразка, багатого РНКазою (наприклад, підшлункової залози), вимагає зберігання формальдегіду для збереження високоякісної РНК, особливо для тривалого зберігання.РНК, виділена з печінки щурів, в основному розкладалася після одного тижня зберігання у воді, тоді як РНК, вилучена з селезінки щурів, залишалася стабільною після трьох років зберігання у воді.Крім того, транскрипти розміром понад 4 кб є більш чутливими до слідової деградації РНКази, ніж малі транскрипти.Щоб підвищити стабільність зразка РНК для зберігання, РНК можна розчинити в іонному металаміні та зберігати при -70 °C.Тилід, який використовується для збереження РНК, не повинен містити різних об’єктів, які руйнують РНК.РНК, отримана з підшлункової залози, може зберігатися в металаміні принаймні один рік.Коли ви будете готові використовувати РНК, ви можете використати наступні методи для осадження РНК: додайте NaCl до 0,2 мл і в 4 рази більше етанолу, помістіть при кімнатній температурі на 3-5 хвилин і відцентруйте 10 000 × g протягом 5 хвилин.
2. Використовуйте зворотну транскриптазу без активності РНКази H (RNaseH-):
Інгібітори РНКази часто додають до реакцій зворотної транскрипції для збільшення довжини та виходу синтезу кДНК.Інгібітор РНКази додається в першій реакції ланцюгового синтезу в присутності буферів і відновників, таких як DTT, оскільки процес попереднього синтезу кДНК денатурує інгібітор, таким чином вивільняючи зв’язані РНКази, які розкладають РНК.Інгібітор протеїнової РНКази лише запобігає деградації РНК РНКазами A, B, C і не запобігає потраплянню РНКаз на шкіру, тому слід бути обережним, щоб не ввести РНКази з пальців, незважаючи на використання цих інгібіторів.
Зворотна транскриптаза каталізує перетворення РНК в кДНК.І M-MLV, і AMV мають ендогенну активність РНКази H на додаток до власної полімеразної активності.Активність РНКази H конкурує з активністю полімерази щодо гетерозиготних ланцюгів, утворених між матрицями РНК і праймерами ДНК або подовжуючими ланцюгами кДНК, і руйнує ланцюги РНК: РНК у комплексах ДНК.Матриці РНК, деградовані активністю РНКази, більше не можуть використовуватися як ефективні субстрати для синтезу кДНК, зменшуючи вихід і тривалість синтезу кДНК.Таким чином, усунення або значне зниження активності РНКази H зворотної транскриптази буде мати велику користь.
Зворотна транскриптаза SuperScriptⅡ, зворотна транскриптаза MMLV РНКази H- і зворотна транскриптаза thermoScript, AMV РНКази H- дали більше кДНК повної довжини, ніж MMLV і AMV.На чутливість RT-PCR впливає кількість синтезованої кДНК.ThermoScript набагато чутливіший, ніж AMV.Розмір продуктів RT-PCR обмежений здатністю зворотної транскриптази синтезувати кДНК, особливо при клонуванні більших ЦДНК.Порівняно з MMLV, SuperScripⅡ значно збільшив вихід довгих продуктів RT-PCR.Зворотна транскриптаза RNaseH- також підвищує термічну стабільність, тому реакцію можна проводити при температурах, вищих за норму, 37-42 ℃.У запропонованих умовах синтезу використовували оліго(dT) праймери та 10 мкКі [альфа-p]dCTP.Загальне виробництво першого ланцюга було розраховано за допомогою методу осадження TCA.Повнорозмірну кДНК аналізували за допомогою видалення смужок із сортуванням за розміром та підрахунку в лужному агарозному гелі.
3. Збільште температуру збереження тепла зворотної транскрипції:
Більш висока температура витримки сприяє відкриттю вторинної структури РНК і підвищенню виходу реакції.Для більшості матриць РНК витримування РНК і праймера при 65°C без буфера чи солі та швидке їх охолодження на льоду усуває більшість вторинних структур і дозволяє праймерам зв’язуватися.Однак деякі шаблони все ще мають вторинну структуру навіть після термічної денатурації.Ампліфікацію цих складних матриць можна здійснити за допомогою зворотної транскриптази ThermoScript і шляхом розміщення реакції зворотної транскриптази при вищих температурах для покращення ампліфікації.Більш високі температури витримування також можуть збільшити специфічність, особливо коли синтез кДНК виконується з використанням ген-специфічних праймерів (GSPS) (див. Розділ 3).Якщо використовується GSP, переконайтеся, що значення Tm праймера збігається з очікуваною температурою витримки.Не використовуйте оліго(dT) і випадкові праймери вище 60 ℃.Випадкові праймери потрібно витримувати при 25 ℃ протягом 10 хвилин перед підвищенням до 60 ℃.На додаток до використання вищих температур зворотної транскрипції, специфічність можна покращити шляхом безпосереднього перенесення суміші РНК/праймера з температури денатурації 65 ℃ до температури утримування зворотної транскрипції та додавання попередньо нагрітої 2× реакційної суміші (синтез термічної ініціації кДНК).Цей підхід допомагає запобігти міжмолекулярному спаровуванню основ, яке відбувається за нижчих температур.Використання ПЛР-інструменту спрощує перемикання багатьох температур, необхідних для ЗТ-ПЛР.
Термостабілізована полімераза Tth діє як ДНК-полімераза в присутності Mg2+ і РНК-полімераза в присутності Mn2+.Він може підтримувати температуру до 65 ℃.Однак присутність Mn2+ під час ПЛР знижує точність, що робить Tth-полімеразу менш придатною для високоточної ампліфікації, такої як клонування кДНК.Крім того, Tth є менш ефективним при зворотній транскрипції, що знижує чутливість, і оскільки єдиний фермент може виконувати зворотну транскрипцію та ПЛР, контрольні реакції без зворотної транскрипції не можна використовувати для відмінності ампліфікованих продуктів кДНК від продуктів забрудненої геномної ДНК.
4. Добавка, яка сприяє зворотній транскрипції:
Додавання добавок, включаючи гліцерин і ДМСО, до першої реакції ланцюгового синтезу може знизити стабільність подвійного ланцюга нуклеїнової кислоти та розкрутити вторинну структуру РНК.Можна додати до 20% гліцерину або 10% ДМСО, не впливаючи на активність SuperScriptⅡ або MMLV.AMV також може переносити до 20% гліцерину без зниження активності.Щоб максимізувати чутливість RT-PCR у реакції зворотної транскрипції SuperScriptⅡ, можна додати 10% гліцерину та ізолювати при 45 ℃.Якщо до ПЛР додати 1/10 продукту реакції ретротранскрипції, концентрація гліцерину в реакції ампліфікації становитиме 0,4%, чого недостатньо для інгібування ПЛР.
5. Обробка РНКази H:
Чутливість можна покращити, обробивши реакції синтезу кДНК РНКазою Н перед ПЛР.Вважається, що для деяких матриць РНК у реакції синтезу кДНК перешкоджає зв’язуванню ампліфікованих продуктів, і в цьому випадку обробка РНКази H може підвищити чутливість.Як правило, обробка РНКази H необхідна для ампліфікації відносно довгої матриці-мішені повної довжини кДНК, такої як туберозний шерозⅡ з низькою копією.Для цього складного шаблону РНКаза H посилила сигнал, створений кДНК, синтезованою SuperScriptⅡ або AMV.Для більшості реакцій RT-PCR обробка РНКази H є необов’язковою, оскільки етап денатурації ізольованої ПЛР при 95 ℃ зазвичай гідролізує РНК із комплексу РНК: ДНК.
6. Покращені методи виявлення невеликих кількостей РНК:
RT-PCR особливо складна, коли доступна лише невелика кількість РНК.Додавання глікогену як носія під час розділення РНК сприяє збільшенню виходу малих зразків.Одночасно з Тризолом можна додавати вільний від РНКази глікоген.Глікоген є водорозчинним і може залишатися у водній фазі з РНК для сприяння подальшому осадженню.Рекомендована концентрація глікогену, вільного від РНКази, становить 250 мкг/мл для зразків менше 50 мг тканини або 106 культивованих клітин.
Додавання ацетильованого BSA до реакцій зворотної транскрипції за допомогою SuperScriptⅡ може підвищити чутливість, а для малих кількостей РНК зменшення кількості SuperScriptⅡ і додавання 40 одиниць інгібітора нуклеази RnaseOut може покращити рівень виявлення.Якщо для розділення РНК використовується глікоген, до реакцій зворотної транскрипції за допомогою SuperScriptⅡ все одно рекомендується додавати інгібітори BSA або РНКази.
Ⅱ. Підвищення специфічності RT-PCR
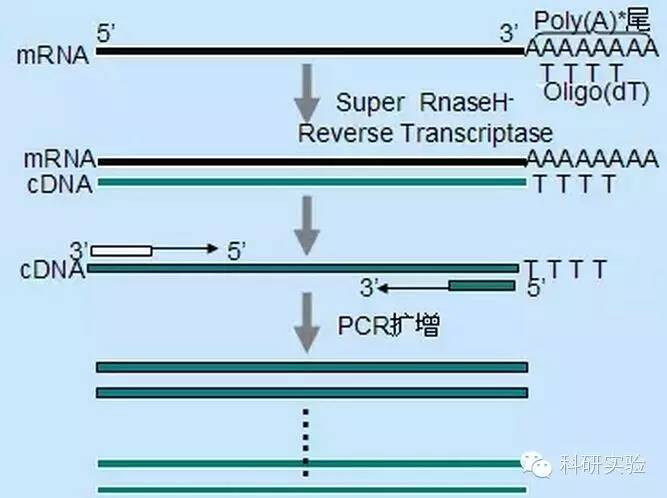
1. Синтез cNDA:
Для ініціації синтезу кДНК першого ланцюга можна використовувати три різні методи, і відносна специфічність кожного методу впливає на кількість і тип синтезованої кДНК.
Метод випадкового праймера є найменш конкретним із трьох методів.Праймери відпалюються в кількох місцях транскрипту для отримання короткої кДНК часткової довжини.Цей метод часто використовують для отримання 5'-кінцевих послідовностей і кДНК з матриць РНК із вторинними структурними ділянками або з термінуючими сайтами, які зворотна транскриптаза не може реплікувати.Щоб отримати найдовшу кДНК, співвідношення праймерів і РНК у кожному зразку РНК потрібно визначити емпірично.Початкова концентрація випадкових праймерів коливається від 50 до 250 нг на 20 мкл реакційної системи.Оскільки кДНК, синтезована з тотальної РНК за допомогою випадкових праймерів, є переважно рибосомальною РНК, полі(А)+РНК зазвичай вибирають як матрицю.
Ініціація Oligo(dT) більш специфічна, ніж випадкові праймери.Він гібридизується з полі(А) хвостом, який знаходиться на 3'-кінці мРНК у більшості еукаріотичних клітин.Оскільки полі(А)+РНК становить приблизно від 1% до 2% загальної РНК, кількість і складність кДНК набагато менші, ніж у разі використання випадкових праймерів.Через свою високу специфічність оліго(dT) зазвичай не потребує оптимізації співвідношення РНК і праймера та відбору полі(А)+.Рекомендується використовувати 0,5 мкг оліго(dT) на 20 мкл реакційної системи.oligo(dT)12-18 підходить для більшості RT-PCR.Система ThermoScript RT-PCR забезпечує оліго(dT)20 завдяки своїй високій термічній стабільності та підходить для більш високих температур зберігання.
Геноспецифічні праймери (GSP) є найкращими специфічними праймерами для етапу зворотної транскрипції.GSP є антисмисловим олігонуклеозидом, який може спеціально гібридизуватися з цільовими послідовностями РНК, а не відпалювати всі РНК, як випадкові праймери або оліго(dT).Правила, які використовуються для розробки ПЛР-праймерів, також застосовуються до конструкції реакції зворотної транскрипції GSP.GSP може бути такою ж послідовністю, що й праймер ампліфікації, відпалений на кінці мРНК3', або GSP може бути розроблений для відпалювання нижче за течією за допомогою праймера зворотної ампліфікації.Для деяких ампліфікованих об’єктів необхідно розробити більше ніж один антисмисловий праймер для успішної RT-PCR, оскільки вторинна структура цільової РНК може перешкоджати зв’язуванню праймера.Пропонується використовувати 1 пмоль антисмислового GSP у системі першої реакції ланцюгового синтезу 20 мкл.
2. Підвищити температуру збереження тепла зворотної транскрипції:
Для повного використання переваг специфічності GSP слід використовувати зворотну транскриптазу з високою термічною стабільністю.Термостабільну зворотну транскриптазу можна ізолювати при більш високих температурах для підвищення жорсткості реакції.Наприклад, якщо GSP відпалюється при 55°C, то специфічність GSP не використовується повністю, якщо зворотна транскрипція виконується при 37°C з низькою суворістю з використанням AMV або M-MLV.Однак SuperScripⅡ і ThermoScript можуть реагувати при 50 ℃ або вище, що виключає неспецифічні продукти, вироблені при нижчих температурах.Для максимальної специфічності суміш РНК/праймер можна перенести безпосередньо з температури денатурації 65 ℃ до температури утримання зворотної транскрипції з додаванням попередньо нагрітої 2-кратної реакційної суміші (теплова ініціація синтезу кДНК).Це допомагає запобігти спаровуванню основ між молекулами при низьких температурах.Використання ПЛР-інструменту спрощує багато температурних переходів, необхідних для ЗТ-ПЛР.
3. Зменшити забруднення геномної ДНК:
Однією з потенційних труднощів з RT-PCR є те, що РНК забруднює геномну ДНК.Використання кращих методів розділення РНК, таких як реагент Trizol, зменшує забруднення геномної ДНК у препаратах РНК.Щоб уникнути продуктів, отриманих із геномної ДНК, РНК можна обробити ДНК Ⅰ ступеня ампліфікації для видалення забрудненої ДНК перед зворотною транскрипцією.Зразки витримували при 65 ℃ в 2,0 мМ EDTA протягом 10 хвилин, щоб припинити розщеплення ДНКазоюⅠ.EDTA хелатує іони магнію, щоб запобігти залежному від іонів магнію гідролізу РНК, який відбувається при високих температурах.
Щоб відокремити ампліфіковану кДНК від продукту ампліфікації геномної ДНК, можна сконструювати праймери, які відпаюють окремо з відокремленим екзоном.Продукти ПЛР, отримані з кДНК, будуть коротшими, ніж продукти, отримані з забрудненої геномної ДНК.Контрольований експеримент без зворотної транскрипції також виконується на кожній матриці РНК, щоб визначити, чи є даний фрагмент геномною ДНК чи кДНК.Продукти ПЛР, отримані за відсутності зворотної транскрипції, отримують з геному.
Супутній продукт
- Одноетапний набір дозволяє проводити зворотну транскрипцію та ПЛР в одній пробірці.Потрібно лише додати матричну РНК, специфічні ПЛР-праймери та ddH без РНКази2O.
-Кількісний аналіз РНК у режимі реального часу можна провести швидко й точно.
-Набір використовує унікальний реагент зворотної транскрипції Foregene і ДНК-полімеразу Foregene HotStar Taq у поєднанні з унікальною реакційною системою для ефективного підвищення ефективності ампліфікації та специфічності реакції.
- Оптимізована реакційна система робить реакцію більш високою чутливістю виявлення, міцнішою термічною стабільністю та кращою толерантністю.
- Ефективна здатність видаляти гДНК, яка може видалити гДНК у шаблоні протягом 2 хвилин.
-Ефективна система зворотної транскрипції, для завершення синтезу першого ланцюга кДНК потрібно лише 15 хвилин.
-Складні шаблони: шаблони з високим вмістом GC і складною вторинною структурою також можуть бути звернені з високою ефективністю.
-Високочутлива система зворотної транскрипції, шаблони рівня pg також можуть отримати високоякісну кДНК.
- Система зворотної транскрипції має високу термічну стабільність, оптимальна температура реакції становить 42 ℃, і вона все ще має хороші показники зворотної транскрипції при 50 ℃.
Час публікації: 07 березня 2023 р