Будучи новою в лабораторії, не дуже добре відсіювати позитивні рослини з групи рослин із низьким рівнем конверсії.Спочатку з великої кількості зразків один за одним необхідно виділити ДНК, а потім за допомогою ПЛР виявлять чужорідні гени.Однак результати часто пусті, а час від часу смуги з кількома елементами, але неможливо визначити, чи є пропущені виявлення чи помилкові виявлення..Чи дуже безпорадно зіткнутися з таким експериментальним процесом і результатами?Не хвилюйся, брат навчить тебе, як легко й точно відсіювати трансгенні позитивні рослини.
Крок 1
Праймери виявлення дизайну
Визначте ендогенний ген і екзогенний ген, які необхідно виявити, відповідно до зразка, який потрібно перевірити, і виберіть репрезентативну послідовність 100-500 bp в гені для дизайну праймера.Хороші праймери можуть забезпечити точність результатів виявлення та скоротити час виявлення (дивіться додаток для праймерів, які зазвичай використовуються).
Примітка. Нещодавно розроблені праймери потребують оптимізації умов реакції та перевірки точності, точності та межі виявлення перед великомасштабним виявленням.
Крок 2
Розробити протокол експерименту
Позитивний контроль: використовуйте очищену ДНК, що містить цільовий фрагмент, як матрицю, щоб визначити, чи система та умови реакції ПЛР є нормальними.
Негативний/порожній контроль: використовуйте шаблон ДНК або ddH2O, який не містить цільового фрагмента, як шаблон, щоб визначити, чи є джерело забруднення в системі ПЛР.
Внутрішній еталонний контроль: використовуйте комбінацію праймер/зонд ендогенного гена зразка, який потрібно перевірити, щоб оцінити, чи можна виявити матрицю за допомогою ПЛР.
Примітка:
Позитивні, негативні/порожні контролі та внутрішні контрольні контролі повинні бути встановлені для кожного тесту, щоб оцінити достовірність результатів експерименту.
Підготовка досліду
Перед використанням перевірте, чи рівномірно змішаний розчин.При виявленні осаду перед використанням його необхідно розчинити і перемішати відповідно до інструкції.Щоб уникнути нерівномірного розподілу іонів, суміш 2 × ПЛР потрібно відпіпетувати та повторно перемішати мікропіпеткою.
Примітка:
Вийміть інструкцію і уважно прочитайте її, а також підготуйтеся до експерименту в суворій відповідності до вимог інструкції.
Крок 4
Підготуйте реакційну систему ПЛР
Відповідно до протоколу експерименту рівномірно змішайте праймери, H2O та 2×PCR, відцентрифугуйте та розподіліть їх у кожну реакційну пробірку.
Примітка:
Для широкомасштабного або тривалого тестування рекомендується використовувати реакційну систему ПЛР, що містить фермент UNG, який може ефективно уникнути аерозольного забруднення, викликаного продуктами ПЛР.
Крок 5
Додайте шаблон реакції
Використовуючи технологію Direct PCR, немає потреби у виснажливому процесі очищення нуклеїнових кислот, шаблон зразка можна підготувати протягом 10 хвилин і додати відповідну реакційну систему ПЛР.
Примітка:
Метод розщеплення має кращий ефект виявлення, і отриманий продукт можна використовувати для багатьох реакцій виявлення.
5.1: Пряме розширення листя
Відповідно до розміру малюнка в посібнику, виріжте тканину листа діаметром 2-3 мм і помістіть її в реакційну систему ПЛР.
Примітка: Переконайтеся, що фрагменти листя повністю занурені в реакційний розчин ПЛР, і не додавайте надмірну кількість тканини листя.
5.2: Метод розщеплення листя
Відріжте тканину листа діаметром 5-7 мм і помістіть її в центрифужну пробірку.Якщо ви обираєте зріле листя, уникайте використання тканин головної жилки листа.Прокапайте 50 мкл лізату буфера P1 у центрифужну пробірку, щоб переконатися, що лізат може повністю занурити тканину листа, помістіть його в термоциклер або металеву ванну та лізуйте при 95°C протягом 5-10 хвилин.
Додайте 50 мкл нейтралізаційного розчину буфера P2 і добре перемішайте.Отриманий лізат можна використовувати як матрицю та додати до реакційної системи ПЛР.
Примітка. Кількість матриці становить 5-10% від ПЛР-системи і не повинна перевищувати 20% (наприклад, у 20-мкл ПЛР-систему додайте 1-2 мкл розчину для лізису, не більше 4 мкл).
Крок 6
ПЛР реакція
Після центрифугування пробірку з реакцією ПЛР її поміщають в прилад для ПЛР для ампліфікації.
Примітка:
У реакції для ампліфікації використовується неочищена матриця, тому кількість циклів ампліфікації на 5-10 більше циклів, ніж при використанні очищеної матриці ДНК.
Крок 7
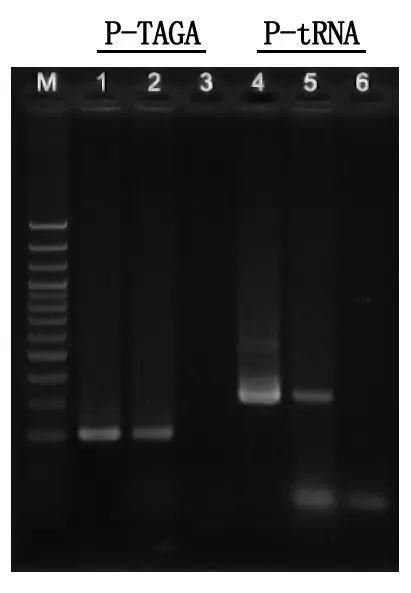
Виявлення та аналіз результатів електрофорезу
M: сходи ДНК 100 bp
1\4: Метод очищеної ДНК
2\5: Метод прямої ПЛР
3\6: Пустий контроль
КК:
Результати тестування різних контролів, встановлених в експерименті, повинні відповідати наступним умовам.В іншому випадку слід проаналізувати причину проблеми та провести тест знову після усунення проблеми.
Таблиця 1. Нормальні результати тестування різних контрольних груп
*Якщо плазміду використовують як позитивний контроль, результат тесту на ендогенний ген може бути негативним
Судження за результатами:
A. Результат тесту ендогенного гена зразка є негативним, що вказує на те, що ДНК, придатну для звичайного ПЛР-детектування, не може бути вилучено із зразка або вилучена ДНК містить інгібітори реакції ПЛР, і ДНК слід виділити повторно.
B. Результат тесту ендогенного гена зразка є позитивним, а результат тесту екзогенного гена негативним, що вказує на те, що зі зразка виділено ДНК, придатну для звичайного ПЛР-детектування, і можна судити про те, що ген ХХХ у зразку не виявлено.
C. Результат тесту на ендогенний ген зразка є позитивним, а результат тесту на екзогенний ген є позитивним, що вказує на те, що зі зразка було виділено ДНК, придатну для звичайного ПЛР-детектування, і ДНК зразка містить ген XXX.Експерименти для підтвердження можуть бути додатково проведені.
Крок 8
Праймери виявлення дизайну
Після експерименту використовуйте 2% розчин гіпохлориту натрію та 70% розчин етанолу, щоб протерти експериментальну зону, щоб запобігти забрудненню навколишнього середовища.
Час публікації: 08 вересня 2021 р