ПЛР (полімеразна ланцюгова реакція) є однією з технологій in vitro ампліфікації ДНК, історія якої налічує понад 30 років.
Технологія ПЛР була започаткована Кері Маллісом із міста Кетус, США, у 1983 році. Мулліс подав заявку на отримання патенту на ПЛР у 1985 році й того ж року опублікував першу наукову статтю про ПЛР на тему «Наука».У 1993 році за свою роботу Мулліс був удостоєний Нобелівської премії з хімії.
Основні принципи ПЛР
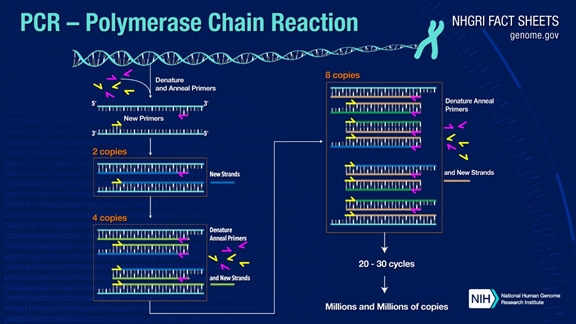
ПЛР може ампліфікувати цільові фрагменти ДНК більш ніж в мільйон разів.Принцип полягає в каталізі ДНК-полімерази, яка використовує батьківську ланцюг ДНК як матрицю та специфічний праймер як вихідну точку для подовження.Він відтворюється in vitro за допомогою таких етапів, як денатурація, відпал і розширення.Процес дочірньої ланцюга ДНК, комплементарний матричній ДНК батьківського ланцюга.
Стандартний процес ПЛР ділиться на три етапи:
1. Денатурація: використовуйте високу температуру для розділення подвійних ланцюгів ДНК.Водневий зв'язок між подвійними ланцюгами ДНК розривається при високій температурі (93-98 ℃).
2. Відпал: після відокремлення дволанцюгової ДНК знизити температуру, щоб праймер міг зв’язатися з одноланцюговою ДНК.
3. Подовження: ДНК-полімераза починає синтезувати комплементарні ланцюги вздовж ланцюгів ДНК із зв’язаних праймерів, коли температура знижується.Коли подовження завершується, цикл завершується, і кількість фрагментів ДНК подвоюється
Повторюючи ці три кроки 25-35 разів, кількість фрагментів ДНК зростатиме експоненціально.
Винахідливість ПЛР полягає в тому, що різні праймери можуть бути розроблені для різних цільових генів, так що фрагменти цільового гена можуть бути ампліфіковані за короткий проміжок часу.
На даний момент ПЛР можна розділити на три категорії, а саме звичайну ПЛР, флуоресцентну кількісну ПЛР і цифрову ПЛР.
Звичайна ПЛР першого покоління
Використовуйте звичайний інструмент ПЛР-ампліфікації для ампліфікації цільового гена, а потім використовуйте електрофорез у агарозному гелі для виявлення продукту, можна провести лише якісний аналіз.
Основні недоліки ПЛР першого покоління:
1. Схильність до неспецифічної ампліфікації та хибнопозитивних результатів.
2. Виявлення займає багато часу, а операція є громіздкою.
3. Можна провести лише якісний тест
ПЛР другого покоління в реальному часі
ПЛР у реальному часі, також відома як КПЦР, використовує флуоресцентні зонди, які можуть вказувати на перебіг реакційної системи, і контролює накопичення ампліфікованих продуктів через накопичення флуоресцентних сигналів, а також оцінює результати за допомогою кривої флуоресценції.Його можна кількісно визначити за допомогою значення Cq і стандартної кривої.
Оскільки технологія qPCR виконується в закритій системі, ймовірність зараження зменшується, а сигнал флуоресценції можна контролювати для кількісного виявлення, тому вона найбільш широко використовується в клінічній практиці та стала домінуючою технологією в ПЛР.
Флуоресцентні речовини, які використовуються у флуоресцентній кількісній ПЛР у реальному часі, можна розділити на: флуоресцентний зонд TaqMan, молекулярні маяки та флуоресцентний барвник.
1) Флуоресцентний зонд TaqMan:
Під час ПЛР-ампліфікації додається специфічний флуоресцентний зонд, додаючи пару праймерів.Зонд є олігонуклеотидом, і обидва кінці помічені репортерною флуоресцентною групою та гасильною флуоресцентною групою.
Коли зонд неушкоджений, флуоресцентний сигнал, випромінюваний репортерною групою, поглинається групою гасіння;під час ПЛР-ампліфікації екзонуклеазна активність 5′-3′ ферменту Taq розщеплює та розщеплює зонд, роблячи репортерну флуоресцентну групу та гасник. Флуоресцентна група відокремлюється, щоб система моніторингу флуоресценції могла приймати сигнал флуоресценції, тобто щоразу, коли ланцюг ДНК ампліфікується, утворюється флуоресцентна молекула, а накопичення сигналу флуоресценції відбувається повністю синхронізується з утворенням продукту ПЛР.
2) флуоресцентний барвник SYBR:
У реакційну систему ПЛР додається надлишок флуоресцентного барвника SYBR.Після того, як флуоресцентний барвник SYBR неспецифічно включений у подвійний ланцюг ДНК, він випромінює флуоресцентний сигнал.Молекула барвника SYBR, яка не включена в ланцюг, не буде випромінювати флуоресцентний сигнал, тим самим забезпечуючи флуоресцентний сигнал. Збільшення продуктів ПЛР повністю синхронізовано зі збільшенням продуктів ПЛР.SYBR зв’язується лише з дволанцюговою ДНК, тому криву плавлення можна використовувати для визначення специфічності реакції ПЛР.
3) Молекулярний маяк:
Це подвійно мічений олігонуклеотидний зонд зі стовбуровою петлею, який утворює структуру шпильки приблизно з 8 основ на 5 і 3 кінцях.Послідовності нуклеїнової кислоти на обох кінцях комплементарно з’єднуються, що призводить до того, що флуоресцентна група та група гасіння є тісними.Закрийте, флуоресценції не буде.
Після генерації продукту ПЛР під час процесу відпалу середня частина молекулярного маяка з’єднується з певною послідовністю ДНК, а флуоресцентний ген відокремлюється від гена гасника для отримання флуоресценції.
Основні недоліки ПЛР другого покоління:
Чутливість все ще недостатня, а виявлення низькокопійних зразків є неточним.
Існує вплив фонового значення, і результат чутливий до перешкод.
Якщо в реакційній системі є інгібітори ПЛР, результати виявлення чутливі до перешкод.
Цифрова ПЛР третього покоління
Цифрова ПЛР (DigitalPCR, dPCR, Dig-PCR) обчислює кількість копій цільової послідовності за допомогою визначення кінцевої точки та може виконувати точне абсолютне кількісне виявлення без використання внутрішнього контролю та стандартних кривих.
Цифрова ПЛР використовує виявлення кінцевої точки і не залежить від значення Ct (порогове значення циклу), тому на реакцію цифрової ПЛР менше впливає ефективність ампліфікації, а толерантність до інгібіторів реакції ПЛР покращується з високою точністю та відтворюваністю.
Завдяки характеристикам високої чутливості та високої точності інгібітори ПЛР-реакцій нелегко впливають на нього, і він може досягти справжнього абсолютного кількісного визначення без використання стандартних продуктів, що стало гарячою точкою для досліджень і застосування.
Відповідно до різних форм реакційного блоку, його можна розділити на три основні типи: мікрофлюїдні, чіпові та краплинні системи.
1) Мікрофлюїдна цифрова ПЛР, mdPCR:
На основі мікрофлюїдної технології відокремлюється шаблон ДНК.Мікрофлюїдна технологія може реалізувати наномодернізацію зразка або генерацію крапель меншого розміру, але краплі потребують спеціального методу адсорбції, а потім поєднуються з реакційною системою ПЛР.mdPCR поступово була прийнята на заміну іншим методам.
2) Краплинна цифрова ПЛР, ddPCR:
Використовуйте технологію створення крапель води в маслі, щоб обробити зразок на краплі та розділити реакційну систему, що містить молекули нуклеїнової кислоти, на тисячі нанорозмірних крапель, кожна з яких не містить цільової молекули нуклеїнової кислоти, яку потрібно виявити, або містить від однієї до кількох цільових молекул нуклеїнової кислоти, які потрібно перевірити.
3) Цифрова ПЛР на основі чіпа, cdPCR:
Використовуйте інтегровану технологію потоку рідини, щоб вигравірувати багато мікропробірок і мікропорожнин на кремнієвих пластинах або кварцовому склі та контролювати потік розчину через різні контрольні клапани, а також розділити рідину зразка на нанометри однакового розміру в реакційні лунки для цифрової ПЛР-реакції для досягнення абсолютної кількісної оцінки.
Основні недоліки ПЛР третього покоління:
Обладнання та реактиви дорогі.
Вимоги до якості шаблону високі.Якщо кількість шаблону перевищує кількість мікросистеми, її буде неможливо кількісно визначити, а якщо вона занадто мала, точність кількісного визначення буде знижена.
Хибнопозитивні результати також можуть виникати при неспецифічній ампліфікації.
Час публікації: 30 липня 2021 р