Вихідний матеріал: РНК
Кількісна ПЛР зі зворотною транскрипцією (RT-qPCR) — це експериментальний метод, який використовується в експериментах ПЛР із використанням РНК як вихідного матеріалу.У цьому методі загальна РНК або матрична РНК (мРНК) спочатку транскрибується в комплементарну ДНК (кДНК) за допомогою зворотної транскриптази.Згодом була проведена реакція КПЦР з використанням кДНК як матриці.RT-qPCR використовувався в різноманітних додатках молекулярної біології, включаючи аналіз експресії генів, перевірку РНК-інтерференції, перевірку мікрочіпів, виявлення патогенів, генетичне тестування та дослідження хвороб.
Одноетапний та двоетапний методи RT-qPCR
RT-qPCR може бути виконано одноетапним або двоетапним методом.Одноетапна RT-qPCR поєднує зворотну транскрипцію та ПЛР-ампліфікацію, дозволяючи зворотній транскриптазі та ДНК-полімеразі завершити реакцію в одній пробірці за однакових умов буфера.Одноетапна RT-qPCR вимагає лише використання праймерів, специфічних для послідовності.У двоетапній RT-qPCR зворотна транскрипція та ПЛР-ампліфікація виконуються у двох пробірках із використанням різних оптимізованих буферів, умов реакції та стратегій розробки праймерів.
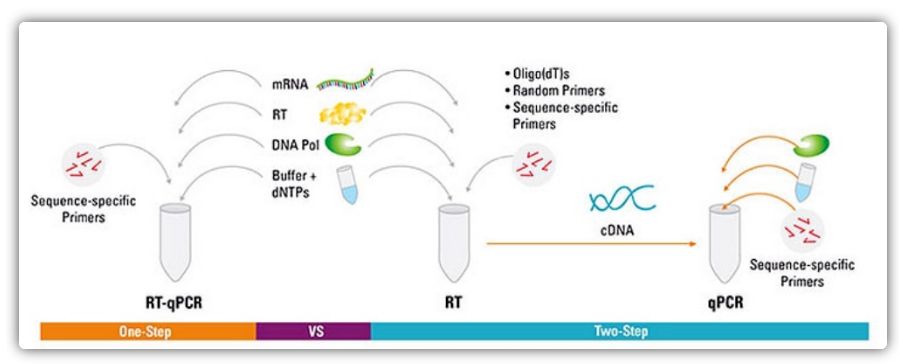
| Перевага | Недолік | |
| Один крок | Цей метод має меншу експериментальну похибку, оскільки обидві реакції проводяться в одній пробірці
Менша кількість етапів дозування зменшує ризик зараження
Підходить для високопродуктивної ампліфікації/скринінгу, швидкий і відтворюваний | Двоступеневі реакції не можна оптимізувати окремо
Оскільки умови реакції погіршуються при поєднанні двоетапної реакції, чутливість не така хороша, як у двоетапного методу
Кількість мішеней, виявлених одним зразком, невелика |
| Два кроки | Можливість створювати стабільні бібліотеки кДНК, які можна зберігати протягом тривалого періоду часу та використовувати в багатьох реакціях
Цільові гени та референсні гени можуть бути ампліфіковані з однієї бібліотеки кДНК без необхідності використання кількох бібліотек кДНК
Реакційні буфери та умови реакції, які дозволяють оптимізувати прогони однієї реакції
Гнучкий вибір умов запуску | Використання кількох пробірок і більше етапів піпетування збільшує ризик зараження ДНК, і займає багато часу.
Потребує більшої оптимізації, ніж одноетапний метод |
Супутні товари:
RT-qPCR Easyᵀᴹ (One Step)-SYBR Green I
RT-qPCR Easyᵀᴹ (Один крок)-Taqman
RT Easyᵀᴹ I Майстер-премікс для синтезу першого ланцюга CDNA
ПЛР у реальному часі Easyᵀᴹ-SYBR Green I Kit
ПЛР у реальному часі Easyᵀᴹ-Taqman
Виділення тотальної РНК і мРНК
Під час розробки експерименту RT-qPCR важливо вирішити, чи використовувати загальну РНК чи очищену мРНК як шаблон для зворотної транскрипції.Хоча мРНК може забезпечити дещо вищу чутливість, тотальна РНК все ще часто використовується.Причина цього полягає в тому, що повна РНК має більш важливу перевагу як вихідний матеріал, ніж мРНК.По-перше, процес вимагає меншої кількості етапів очищення, що забезпечує краще кількісне відновлення матриці та кращу нормалізацію результатів до початкової кількості клітин.По-друге, це дозволяє уникнути етапу збагачення мРНК, що може уникнути можливості викривлення результатів через різне відновлення різних мРНК.Загалом, оскільки в більшості застосувань відносне кількісне визначення цільового гена важливіше, ніж абсолютна чутливість виявлення, у більшості випадків загальна РНК є більш придатною.
Праймер зворотної транскрипції
У двоетапному методі можна використовувати три різні методи для праймування реакції кДНК: праймери оліго(dT), випадкові праймери або праймери, специфічні для послідовності.Як правило, оліго(dT) праймери та випадкові праймери використовуються в комбінації.Ці праймери приєднуються до ланцюга мРНК-матриці та забезпечують зворотну транскриптазу початковою точкою для синтезу.
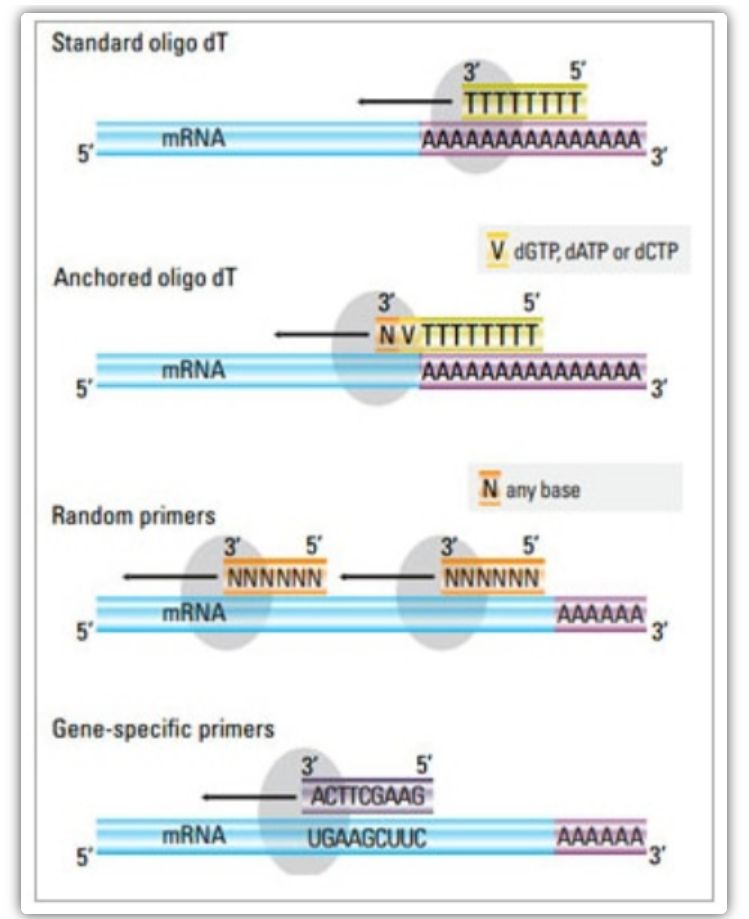
| Вибір грунтовки | Будова і функції | Перевага | Недолік |
| Оліго(dT) праймер (або закріплений оліго(dT) праймер) | Розширений відпал до залишків тиміну в полі(А) хвості мРНК;якірний оліго(dT) праймер містить G, C або A на 3' кінці (місце прив’язки) | Синтез повнорозмірної кДНК з полі(А)-кінцевої мРНК
Застосовується, коли доступно менше вихідного матеріалу
Сайт прикріплення гарантує, що оліго(dT) праймер зв’язується з 5′ полі(А) хвостом мРНК | Підходить лише для ампліфікації генів із полі(А) хвостами
Отримайте кДНК, усічену з сайту праймування*2 у полі(А)
Зміщений для прив'язки до 3'-кінця*
*Ця можливість зводиться до мінімуму, якщо використовуються закріплені оліго(dT) праймери |
| випадковий праймер
| Довжиною від 6 до 9 основ, які можуть приєднуватися до кількох сайтів під час транскрипції РНК | Відпал до всіх РНК (тРНК, рРНК та мРНК)
Підходить для транскриптів із значною вторинною структурою або коли доступно менше вихідного матеріалу
Високий вихід кДНК | кДНК зворотно транскрибується з усіх РНК, що зазвичай небажано і може послабити сигнал мРНК-мішені
отримати усічену кДНК |
| специфічні для послідовності праймери | Спеціальні праймери, націлені на певні послідовності мРНК | специфічна бібліотека кДНК
Поліпшити чутливість
Використання зворотних праймерів qPCR | Обмежується лише синтезом одного цільового гена |
Зворотна транскриптаза
Зворотна транскриптаза - це фермент, який використовує РНК для синтезу ДНК.Деякі зворотні транскриптази мають РНКазну активність і можуть руйнувати ланцюги РНК у гібридних ланцюгах РНК-ДНК після транскрипції.Якщо він не має ферментативної активності РНКази, можна додати РНКазу H для підвищення ефективності КПЦР.Зазвичай використовувані ферменти включають зворотну транскриптазу вірусу мишачого лейкозу Молоні та зворотну транскриптазу вірусу мієлобластоми птахів.Для RT-qPCR ідеально вибрати зворотну транскриптазу з вищою термостабільністю, щоб синтез кДНК можна було виконувати при вищих температурах, забезпечуючи успішну транскрипцію РНК з вищою вторинною структурою, зберігаючи при цьому їх повну активність протягом усієї реакції, що призводить до вищого виходу кДНК.
Супутні товари:
Зворотна транскриптаза Foreasy M-MLV
Активність РНКази H зворотної транскриптази
РНКаза H здатна розщеплювати ланцюги РНК із дуплексів РНК-ДНК, забезпечуючи ефективний синтез дволанцюгової ДНК.Однак при використанні довгої мРНК як матриці РНК може передчасно деградувати, що призведе до укороченої кДНК.Тому часто корисно мінімізувати активність РНКази H під час клонування кДНК, якщо потрібний синтез довгих транскриптів.Навпаки, зворотні транскриптази з активністю РНКази H часто є корисними для додатків кПЛР, оскільки вони посилюють розплавлення дуплексів РНК-ДНК під час першого циклу ПЛР.
Дизайн грунтовки
ПЛР-праймери, які використовуються на етапі кПЦР у RT-qPCR, в ідеалі повинні бути розроблені для охоплення з’єднання екзон-екзон, де праймер ампліфікації потенційно може охоплювати фактичну межу екзон-інтрон.Оскільки послідовності геномної ДНК, що містять інтрон, не ампліфікуються, ця конструкція знижує ризик помилкових позитивних результатів, ампліфікованих через забруднення геномної ДНК.
Якщо праймери не можуть бути розроблені для розділення екзонів або меж екзон-екзон, може виникнути необхідність обробити зразки РНК ДНКазою I або дцДНКазою, що не містить РНКази, щоб видалити забруднення геномної ДНК.
RT-qPCR контроль
Негативний контроль зворотної транскрипції (-RT контроль) слід включити в усі експерименти RT-qPCR для виявлення забруднення ДНК (наприклад, геномної ДНК або продуктів ПЛР з попередніх реакцій).Цей контроль містить усі компоненти реакції, крім зворотної транскриптази.Оскільки зворотна транскрипція не відбувається з цим контролем, якщо спостерігається ПЛР-ампліфікація, найімовірніше зараження ДНК.
Час публікації: 02 серпня 2022 р








